Número: 2.2 - 5 Artigo(s)
- Imprimir
- Indicar
- Estatísticas
- (0) Comentários
- Como Citar
- Download Citação
- Artigos Relacionados
- Outros dos Autores
Artigos de Revisão
Vírus da hepatite G e a coinfecção em pacientes soropositivos para o vírus da imunodeficiência humana - revisão
Hepatitis G virus and coinfection in seropositive for human immunodeficiency virus - review
Luísa Dias da Mota1; Fabiana Nunes Germano2; Maria Fernanda Martinez Barral3; Naylê Maria Oliveira da Silva4; Ana Maria Barral Martinez5
Resumo
FUNDAMENTAÇÃO: O vírus da hepatite G (GBV-C) embora pouco estudado é um vírus com grande distribuição e muito comum na população mundial. A maioria dos estudos relaciona a coinfecção do GBV-C com o HIV como um fator positivo aos pacientes infectados com o HIV.
OBJETIVO: O objetivo deste trabalho foi realizar uma revisão bibliográfica do vírus da hepatite G e a sua coinfecção em pacientes positivo para HIV.
MÉTODOS: Como métodos de busca para realização desta revisão sistemática utilizou-se as bases eletrônicas MEDLINE (National Library of Medicine), LILACS (Literatura Latino-americana e do Caribe em Ciências da Saúde) e ScieLo (Scientific eletronic Library online), usando as seguintes palavras-chave: vírus GB-C, agentes anti-HIV, HIV.
RESULTADOS: Ao final da busca eletrônica foram incluídos 55 artigos, sendo estes estudos epidemiológicos observacionais, experimentais ou revisões bibliográficas. Mesmo que a ação protetora do GBV-C seja controversa na literatura, as evidências científicas apontam que o GBV-C traz uma melhora no prognóstico dos pacientes infectados com o HIV até mesmo com um aumento na contagem de células T CD4+.
CONCLUSÃO: Estes indícios somados a ampla distribuição do vírus GBV-C na população mundial torna relevante que sejam realizados mais estudos deste vírus, para seu melhor entendimento como agente de hepatite viral, levantamentos epidemiológicos de diferentes regiões e sua associação ao HIV nos pacientes coinfectados.
Palavras-chave: Vírus GB C; agentes anti-HIV; HIV-1
INTRODUÇÃO
O vírus da hepatite G (GBV-C) teve sua descoberta através de estudos iniciados a partir da década de 1960(1), mas por não ter apresentado grande impacto clínico nos pacientes, foi ignorado durante este período. Somente após estudos realizados por Toyoda, et al. 1998, e Heringlake, et al. 1998, o interesse pelo GBV-C ficou incontestável(2,3). A partir de estudos e observações, estes pesquisadores propuseram que a associação entre o HIV (vírus da imunodeficiência humana) e o GBV-C poderia trazer resultados benéficos aos pacientes HIV positivo, de tal maneira a retardar a progressão do HIV para a AIDS (síndrome da imunodeficiência adquirida) (2, 3). A infecção com o GBV-C é comum em toda população mundial(4). Através de amostras obtidas de diferentes regiões do mundo, sequências genômicas do GBV-C foram analisadas, o que revelou a existência de seis genótipos (1, 2, 3, 4, 5, 6), sendo estes diretamente relacionados com a região geográfica de origem, sugerindo que o GBV-C é um vírus antigo que foi disseminado com a migração da população ao longo dos anos(4).
O GBV-C apresenta diferentes formas de transmissão sendo a via parenteral a mais importante mediante transfusões de sangue e hemoderivados(5), sendo alta sua prevalência entre usuários de drogas endovenosas (28,8%), hemofílicos (35,2%), hemodialisados (6,8%) e após transfusão sanguínea (21,1%)(6).
Estudos vêm demonstrando que a coinfecção GBV-C/HIV seria um fator positivo para os pacientes infectados pelo HIV, onde a progressão do HIV para a AIDS ocorreria de forma mais lenta (2,3). Foi observado também que os pacientes que já estão com a doença mostram uma maior sobrevida, com menores taxas de mortalidade (2, 3, 7). Ainda há estudos que demonstram que a coinfecção destes vírus leva a um aumento na contagem de células T CD4+(7).
Os mecanismos que levariam a ação protetora do GBV-C ainda permanecem pouco esclarecidos. Uma das hipóteses que tentam explicar os motivos pelos quais o GBV-C minimiza a progressão do HIV é de que o GBV-C teria uma ação inibitória direta na replicação do HIV, devido ao fato de que ambos os vírus se replicam em células mononucleares do sangue periférico inclusive em linfócitos T CD4+, T CD8+ e linfócitos B(7). Esta coinfecção poderia afetar os estágios do ciclo do HIV, como a ligação e fusão às células-alvo, transcrição reversa, incorporação ao genoma da célula hospedeira, produção do pró-vírus dentre outros, diminuindo a replicação do HIV sem aumentar a toxicidade celular(7).
Mesmo que a ação protetora do GBV-C seja controversa na literatura, as evidências científicas demonstram que o GBV-C traz uma melhora no prognóstico dos pacientes infectados com o HIV. Por esta razão e por ser o GBV-C um vírus amplamente espalhado na população mundial, é relevante que sejam realizados mais estudos, tanto para seu melhor entendimento como agente de hepatite viral quanto por sua e a sua coinfecção em pacientes positivos para HIV, analisando os principais aspectos da estrutura viral, dos fatores de risco associados à infecção pelo GBV-C bem como os efeitos da coinfecção GBV-C/HIV em pacientes coinfectados.
MÉTODOS
Estratégias de busca
A revisão bibliográfica foi conduzida pela estratégia de busca de artigos originais em bases eletrônicas e na busca manual de citações nas publicações inicialmente identificadas, de acordo com as seguintes palavras-chave: Vírus GB-C, agentes anti-HIV e HIV-1. Foram utilizadas as bases eletrônicas MEDLINE (National Library of Medicine), LILACS (Literatura Latino-americana e do Caribe em Ciências da Saúde) e ScieLo (Scientific eletronic Library online). A busca manual foi realizada na biblioteca do Campus da Saúde da Universidade Federal do Rio Grande (FURG). Com base no título dos artigos e nos resumos, foram selecionados todos os artigos relevantes para a leitura do texto na íntegra. Também foram examinadas as listas de referências bibliográficas dos artigos selecionados, a fim de detectar mais artigos importantes da área, que não haviam sido identificados na busca original ou que não constavam nas bases de dados pesquisadas. Uma vez lidos todos os artigos, foi iniciado o processo de redação da revisão.
Critérios de inclusão
Nesta revisão incluímos diferentes achados dentre os autores, que apresentaram repercussão na comunidade científica no momento da publicação. Como limites da busca foram incluídos trabalhos escritos em inglês, português ou espanhol. Estando dentre estes quesitos foram selecionados artigos que abordaram a biologia molecular do vírus GBV-C, bem como a coinfecção entre GBV-C e o HIV, sendo estes estudos epidemiológicos observacionais, experimentais e revisões bibliográficas.
Critérios de exclusão
Foram excluídos os artigos com data abaixo do ano 2000, que não apresentaram grande significância para a comunidade científica e com carência de dados.
RESULTADOS
Para realizar esta revisão sistemática utilizamos 55 artigos de acordo com os critérios de inclusão, dentre eles temos estudos epidemiológicos observacionais, experimentais e revisões bibliográficas.
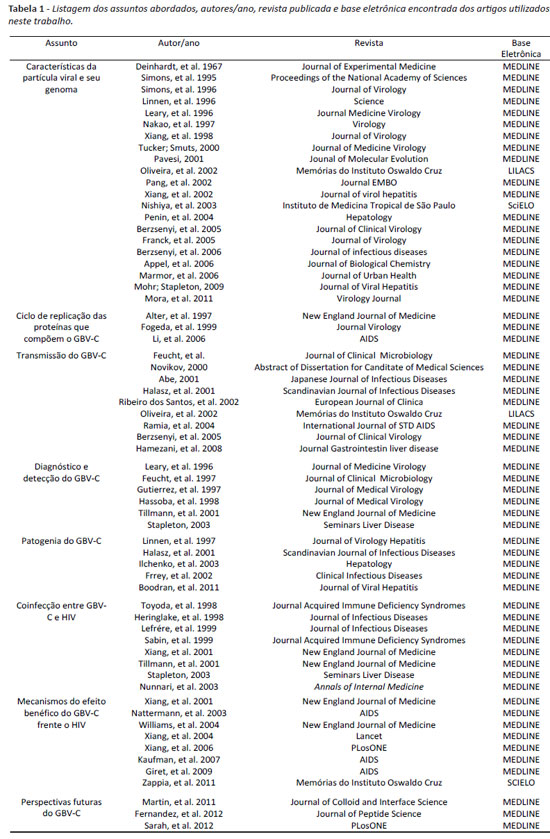
Dentre os diferentes assuntos estudados, 21 artigos foram utilizados para o estudo das características da partícula viral do GBV-C e seu genoma. Destes 15 tratavam-se da organização genômica do GBV-C, das propriedades e funções de suas proteínas estruturais e não estruturais, assim como de suas enzimas virais. Ainda destes 21 trabalhos, dois abordaram a origem e a evolução do GBV-C, através de análise filogenética de seus genótipos, dois tratavam-se dos diferentes genótipos do GBV-C no mundo, dois dos diferentes genótipos no Brasil. no estudo do ciclo de replicação das proteínas que compõem o GBV-C, utilizamos 3 trabalhos, onde um destes refere-se ao tropismo celular do GBV-C, e os outros dois ao possível ciclo de replicação deste agente viral. A transmissão do GBV-C foi revisada em nove artigos, que tratavam-se das vias parenteral, sexual e materno-infantil. nas formas de detecção e diagnóstico do GBV-C foram utilizados seis trabalhos referentes ao diagnóstico molecular e sorológico. Em relação a patogenia, cinco trabalhos foram citados, onde estudamos o comportamento do GBV-C e os sinais e sintomas nos indivíduos infectados. A coinfecção entre o GBV-C e o HIV foi pesquisada em oito trabalhos, aos quais abordam os efeitos benéficos desta coinfecção em diferentes populações. Os mecanismos utilizados pelo GBV-C para exercer um efeito protetor nos indivíduos infectados pelo HIV foi estudado em oito artigos de nossa pesquisa, que sugerem diferentes mecanismos de interação entre o GBV-C e o HIV. As perspectivas futuras deste agente viral na comunidade científica foram vistas em três estudos in vitro, aos quais testam diferentes proteínas do genoma do GBV-C frente a capacidade de inibir a replicação do HIV. A tabela 1 ilustra dentre cada assunto pesquisado, os autores utilizados, ano, revista publicada, e base eletrônica em que os artigos foram encontrados.
DISCUSSÃO
Características da partícula viral e seu genoma
Com base na sequência e organização de seu genoma o GBV-C é classificado como membro da família Flaviviridae, que apresenta três gêneros conhecidos: Flavivirus, Pestivirus e Hepacivirus(8). Conforme ilustrado na figura 1, no momento não é atribuído ao GBV-C nenhum dos gêneros conhecidos, porém vem sendo proposto que ele seja atribuído ao gênero Hepacivirus(8).
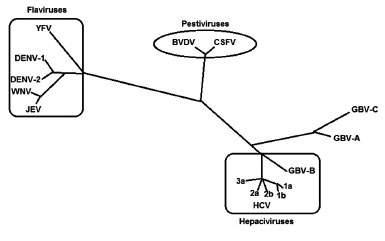
Figura 1 - Relação filogenética da família Flaviviridae.
O GBV-C é um RNA vírus representado por uma fita simples de RNA com polaridade positiva(9). Seu genoma apresenta 9,4 Kb e se organiza de forma semelhante ao HCV conforme figura 2(10, 11). Os diferentes genomas virais isolados do GBV-C apresentam entre 9103 e 9392 nucleotídeos, e contém uma única fase de leitura aberta ORF (open reading Frame), que codifica uma grande poliproteína precursora de 2873 a 2910 aminoácidos(10, 11). A fase de leitura aberta se localiza entre regiões não traduzidas (UTR) nas extremidades 5' e 3' do genoma viral(6).
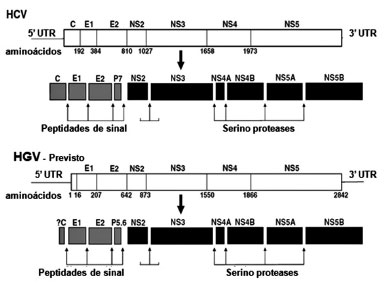
Figura 2 - Organização genômica e o processamento proteolítico
dos vírus HCV e GBV-C(8). Com adaptações.
A região 5' UTR do GBV-C é altamente conservada e é maior que a do HCV, apresenta um sítio interno de entrada ao ribossomo (IRES, internal ribosomal entry site), sendo este o responsável por iniciar a tradução do RNA viral(12). Os IRES são essenciais para a tradução do genoma viral e permitem a ligação direta da subunidade 40s do ribossomo, não necessitando de fatores de pré-inicialização(12). A atividade do IRES é menor no GBV-C do que no HCV(10).
A poliproteína viral traduzida é clivada por uma combinação de proteases da célula hospedeira e proteases virais para então formar as proteínas virais estruturais e enzimas virais(13). As proteínas estruturais do GBV-C são codificadas na região N-terminal da ORF(13). As proteínas estruturais originadas são um capsídeo, cujas regiões codificantes ainda não foram completamente identificadas(14), duas glicoproteínas de envelope, E1 e E2 que formam um heterodímero e estão localizadas na superfície da partícula viral; e um canal iônico (p5.6)(14), conforme figura 2(8).
A porção C-terminal da ORF do GBV-C codifica as proteínas não estruturais, que são: NS2, NS3, NS4A, NS4B, NS5A e NS5B(15), conforme figura 2(8). Apesar de não estarem totalmente caracterizadas experimentalmente, acredita-se que suas funções sejam análogas as proteínas do HCV(15). Sendo assim, após a clivagem por peptidases celulares, NS2 é a primeira protease ativada(16). Sua porção C-terminal contém um domínio protease que, juntamente com o domínio N-terminal de NS3, catalisam a clivagem entre NS2 e NS3(16). Acredita-se que no GBV-C a NS2 exerça funções como: inibição da apoptose, modulação da expressão gênica e fosforilação de NS5A(16). A NS3 é versátil e apresenta atividades de protease serina, RNA helicase e nucleotidase (NTPase)(17). Seu domínio helicase está relacionado à iniciação da síntese de RNA, mediante dissociação das fitas nascentes de RNA e de seus moldes(17). A NS4A é cofator da protease serina, e NS3/NS4A é responsável pela clivagem de todas as proteínas subsequentes(12, 13, 14, 18, 19, 20). A NS4B e NS5A são pouco caracterizadas, porém sabe-se que NS4B recruta proteínas virais e demais componentes da replicase ao sítio de replicação viral e que NS5A interage com sistema imune inato(12, 13, 14, 18, 19, 20). A NS5B é a RNA polimerase RNA-dependente, fundamental para a maquinaria de replicação do RNA(12, 13, 14, 18, 19, 20).
Através de amostras oriundas de todo o mundo, a análise filogenética de sequências genômicas do subtipo GBV-C, revelaram a existência de seis genótipos (1, 2, 3, 4, 5, 6), diretamente relacionados com a região geográfica de origem, sugerindo que o GBV-C é um vírus antigo que foi disseminado com a migração da população ao longo dos anos(4, 21).
A diversidade genética do GBV-C varia de acordo com as diferentes regiões onde o vírus foi detectado; o genótipo 1 predomina principalmente na África ocidental, o genótipo 2 na europa e eUa, o genótipo 3 na Ásia, o genótipo 4 no sudeste asiático o genótipo 5 na África do Sul e o genótipo 6 na indonésia(22).
Em um estudo realizado em doadores de sangue na Colombia, foram analisados 408 indivíduos, com uma prevalência de 5,06% de infecção pelo GBV-C(23). Destes, 41,6% tinham o genótipo 2a, 33,3% o genótipo 1, 16,6% o genótipo 3, e 8,3% o genótipo 2b(23).
No Brasil, poucos estudos foram realizados(24, 25). Na maioria deles foi observado o predomínio dos genótipos 1 e 2 com 8,3 a 17,6% e 82,4 a 91,7% de prevalência respectivamente(24, 25).
O GBV-C é o vírus humano que mais se assemelha ao HCV(6, 15). Através da análise genômica seqüencial observou-se uma homologia em torno de 30% de seus aminoácidos(6,15). A região gênica que apresenta maior homologia é a NS3, ou seja a região codificante da helicase viral(6, 15). Já as porções gênicas que codificam as proteínas do envelope viral E1 e E2 apresentam as maiores diferenças entre estes vírus(6, 15).
Ciclo de replicação das proteínas que compõe o GBV-C
O ciclo de replicação das proteínas que compõe o GBV-C ainda não foi esclarecido, acredita-se que a replicação ocorra no citoplasma, da mesma forma como ocorre a replicação dos outros flavivirus RNA de fita simples com polaridade positiva, através da síntese de uma molécula de RNA de polaridade negativa, a qual serve de molde para a produção de novas fitas positivas(26).
O GBV-C, apesar de ser chamado vírus da hepatite G, apresenta pouco ou nenhum tropismo pelos hepatócitos e a replicação hepática é pouco descrita(27). Estes achados foram demonstrados por alter, et al. 1997, que ao inocularem o vírus em primatas chimpanzés, não conseguiram demonstrar manifestações de doença hepática(27).
O GBV-C apresenta tropismo pelos linfócitos e sua replicação inicial ocorre em células mononucleares do sangue periférico como linfócitos T CD4+, linfócitos B, medula óssea e baço(28).
Transmissão do GBV-C
A infecção com o GBV-C é comum em todo o mundo, e pode ser transmitido pelas vias parenteral, sexual e materno infantil(5, 29, 30).
A via parenteral é a de maior importância, principalmente por transfusão de sangue e hemoderivados(5). O GBVC possui altas taxas de prevalência em indivíduos usuários de drogas injetáveis, hemofílicos, hemodialisados e pacientes transplantados(5).
A evidência indireta da transmissão parenteral do GBV-C são as maiores frequencias detectadas deste vírus em grupos de alto risco de infecção para hepatites virais B e C que apresentam rotas similares de transmissão(31).
Em uma pesquisa realizada por Berzsenyi, et al. 2005, foram analisados indivíduos considerados saudáveis, com ausência de fatores de risco para doenças sexualmente transmissíveis e com taxas de transaminases normais(6). A pesquisa encontrou 1,9% dos pacientes positivos para o GBV-C(6). Destes indivíduos, 6,8% estavam em hemodiálise, 18,2% eram HIV positivo, 24,4% eram HCV positivo, 28,8% eram usuários de drogas endovenosa, 21,1% haviam realizado transfusão de sangue e 35,2% eram hemofílicos(6). Estes achados indicam que a prevalência do GBV-C varia de acordo com a população estudada(6).
Poucos estudos sobre a transmissão do GBV-C foram realizados no Brasil(25). No estado de Goiás, uma pesquisa foi realizada com o objetivo de investigar a prevalência do GBV-C em 241 doadores de sangue(25). Destes, 17 (7,1%) foram positivos para o GBV-C(25).
A transmissão sexual do GBV-C é de grande importância. Em pesquisa realizada por Hamezani, et al. 2008 no Irã, foram analisados a frequencia do GBV-C em 82 pacientes infectados com HIV(32). Os pesquisadores encontraram 10,97% de prevalência de coinfecção GBV-C/HIV sendo que destes indivíduos co-infectados, 13,7% apresentavam fatores de risco somente para transmissão parenteral e 6,7% fatores de risco somente para transmissão sexual(32). Este estudo sugere que a transmissão sexual seja muito eficiente em indivíduos sem fatores de risco para transmissão parenteral(32).
Um estudo realizado no Brasil com 1.039 indivíduos na cidade de São Paulo, demonstrou maior prevalência do GBV-C em indivíduos sexualmente ativos e que realizam práticas sexuais de risco, como homens que fazem sexo com homens(33).
A transmissão materno-infantil do GBV-C também tem sido documentada, uma pesquisa que analisou crianças africanas com mães positivas para o GBV-C, encontrou taxas de 15% de crianças infectadas pelo mesmo vírus(5). Já Halasz, et al. 2001, encontraram 89% de transmissão vertical, sugerindo no entanto que mais pesquisas devem ser feitas para verificar a persistência do GBV-C e a cura espontânea em crianças infectadas por esta via de transmissão(34).
Diagnóstico e detecção do GBV-C
A maioria dos indivíduos assintomáticos infectados com o GBV-C, clareiam o vírus após o desenvolvimento de anticorpos(35). Estes anticorpos são produzidos contra a glicoproteína E2 do envelope viral (anti-E2)(35). O encontro de estes anticorpos é fator indicativo de que o indivíduo já foi exposto ao vírus(29, 36). Técnicas imunoenzimáticas (ELISA), são utilizadas para detectar a presença do anti-E2, indicativo de clareamento viral e imunização frente à reinfecções(29, 36). Devido ao anti-E2 ser um anticorpo neutralizante, quando presente, o indivíduo dificilmente apresentará viremia, a que ocorre somente em 1% dos casos, sugerindo que o anti-E2 está relacionado com infecção pregressa(37).
O diagnóstico molecular para detectar exposição ao GBV-C é também de grande importância. Testes de Biologia molecular como o RT-PCR (reverse transcription polymerase chain reaction) levam à detecção do RNA viral no soro ou plasma do paciente suspeito(15, 37). A técnica de amplificação do ácido nucléico viral por RT-PCR, nested PCR ou real time -PCR, utilizam principalmente as regiões 5' UTR, NS3 e NS5 por serem as regiões mais conservadas do genoma do GBV-C(15, 37). O achado de RNA viral é indicativo de virema ou infecção ativa(15, 37). Pelo exposto acima, seria de grande relevância que estudos voltados a estimar a exposição ao GBV-C fizesse uso de métodos tanto para a detecção do RNA-GBV-C quanto do anti-E2(15, 37). Em um estudo do vírus GBV-C realizado por Hassoba, et al. 1998, foi pesquisado se um grupo de pacientes anti-E2 positivo com necessidade de transplante hepático, continuariam com este anticorpo após o transplante, e se os pacientes anti-E2 positivos pós transplante estariam protegidos do GBV-C frente a uma re-infecção(38). Os pesquisadores concluíram que apesar do transplante hepático causar uma imunossupressão, os anticorpos antiE2 continuaram sendo detectados nos indivíduos positivos anteriormente. Ainda mais, verificaram que a presença do anti-E2 pareceria impedir reinfecções(38).
Patogenia
O mecanismo responsável pelo desenvolvimento de hepatite induzida pelo GBV-C não está claro até hoje. Apesar de este vírus ter sido descoberto em um paciente com quadro de hepatite e de existir casos descritos de hepatite G aguda e crônica, o hepatotropismo permanece controverso(39).
Halasz, et al. 2001, através de pesquisa histológica realizada no fígado de pacientes infectados com este agente viral, acreditam que não exista associação entre a presença do GBV-C e alterações nas células hepáticas(34). Os mesmos resultados foram encontrados por Boodram, et al. 2011(40).
Mesmo diante destes conflitos na literatura em relação à patogenicidade do vírus da hepatite G, a maioria dos autores acredita que o GBV-C provavelmente não seja virulento, nem um agente viral causador de doença hepática grave, não agrave a doença hepática já instalada e não tenha o fígado como sítio primário da infecção(41).
Portanto, os estudos que sugerem que o GBV-C leva ao desenvolvimento de lesão hepática nos indivíduos infectados, são contraditórios, e até o momento não foi possível comprovar que esta associação exista(42). Por este motivo Linnen, et al. 1997, acredita que através de dados da literatura a nomenclatura "vírus da hepatite G (GBV-C)" poderá ser substituída por apenas vírus GB-C(42).
Coinfecção do GBV-C com HIV
Estudos disponíveis na literatura revelam que a coinfecção do GBV-C com o HIV traz prognósticos favoráveis aos pacientes infectados pelo HIV, tendo a progressão do HIV para a AIDS de forma mais lenta, com aumento nas taxas de células T CD4+ proporcionando uma maior sobrevida aos indivíduos infectados com HIV(2, 3, 7).
O HIV é transmitido pelas vias sexual, parenteral e materno-infantil, vias que também disseminam outros agentes, entre eles o GBV-C, fato que explica a alta taxa de infecção do GBV-C em pacientes HIV positivo(43).
Hoje é considerada frequente a coinfecção GBV-C com HIV, já que como dito anteriormente estes dois vírus apresentam transmissão eficiente pelas vias sexual e parenteral ressaltando a importância de estudos para avaliar esta associação(37).
O primeiro estudo relacionando o GBV-C e o HIV foi realizado por Toyoda, et al. 1998, no Japão, despertando o interesse da comunidade científica frente esta coinfecção(2). A pesquisa foi realizada com 41 hemofílicos infectados com HIV por transfusão sanguínea(2). Os pesquisadores além de ter observado uma prevalência de 27% de coinfecção GBV-C e HIV, sugeriram o efeito benéfico do GBV-C para os pacientes HIV positivo, uma vez que estes pacientes apresentaram diminuição na carga viral do HIV(2). Apesar deste achado, os pesquisadores não conseguiram demonstrar se o GBV-C levaria a uma diminuição no tempo de evolução para a AIDS, porém abriram um leque para estudos posteriores relacionando o GBV-C com o HIV(2).
Ainda no mesmo período Heringlake, et al. 1998, realizaram uma pesquisa com 197 indivíduos da alemanha, positivo para HIV, onde procuravam verificar a influência exercida pelo GBV-C no grupo pacientes HIV positivo(3). A infecção para GBV-C foi encontrada em 16,8% dos indivíduos HIV, enquanto que a prevalência de anticorpos anti-E2 foi de 56,8%(3). Os pesquisadores ainda observaram que os pacientes HIV positivos com infecção ativa para o GBV-C (16,8%) tiveram a contagem de células T CD4+ superior em relação aos anti-E2 positivos e aos GBV-C negativos(3).
Os estudos liderados por Sabin, et al. 1999, analisaram a mortalidade de 94 ingleses hemofílicos co-infectados com GBV-C e HIV(44). Os pesquisadores não encontraram diferença significativa sobre a influência GBV-C na mortalidade dos pacientes infectados com HIV(44). Deve-se levar em consideração que este estudo não diferenciou os pacientes que apresentavam infecção ativa pelo GBV-C dos que apresentavam os anticorpos anti-E2, sendo que todos os pacientes estudados foram tidos como expostos ao vírus GBV-C(44).
Em contrapartida à equipe de Sabin, no mesmo ano Lefrére, et al. 1999, confirmaram os resultados encontrados por Toyoda e Heringlake em 1998, em uma pesquisa realizada em aproximadamente 5 anos, com 97 franceses infectados com o HIV(43). O estudo revelou que o grupo infectado com o GBV-C teve contagem de células T CD4+ maiores, com uma menor progressão para AIDS, o que enfatizou o efeito benéfico do GBV-C na população de HIV positivo(43). Ainda mais, foi observado que dentre os pacientes com infecção ativa do GBV-C, apenas 39% necessitaram iniciar a terapia anti-retroviral, enquanto que 68% dos pacientes infectados somente pelo HIV necessitaram das drogas anti-retrovirais(43).
Seguindo a mesma linha de pesquisa Tillmann, et al. 2001, realizaram um estudo com 197 pacientes com AIDS, em uso de terapia anti-retroviral (TARV) (36). Os pesquisadores buscaram elucidar qual a relação a longo prazo entre o GBV-C e os pacientes infectados com o HIV-AIDS(36). Os achados demonstraram que os pacientes positivos para o RNA-GBV-C apresentaram uma menor carga viral do HIV com um avanço mais lento para a doença do que os pacientes mono-infectados com HIV(36). Além disso, foi observado que os indivíduos em uso de TARV, co-infectados com o GBV-C, também apresentaram resultados benéficos em sua sobrevida, com aumento na contagem das células T CD4+(36). Com estes achados os pesquisadores confirmaram que a relação entre o GBV-C e o HIV está associada com taxas de mortalidade reduzida nos pacientes HIV positivo mesmo após a introdução da TARV, sugerindo que a presença do GBV-C inibe a replicação do HIV(36).
Nunnari, et al. 2003, comprovaram o estudo de Tillmann, et al. 2001, através de achados de que o GBV-C levaria os pacientes a uma maior sobrevida, seja antes ou após o início da TARV, com uma melhora na resposta desta terapia(36, 45). Este estudo reforçou os achados em relação ao efeito benéfico aos pacientes HIV quando co-infectados com o GBV-C(45).
Mecanismos do efeito benéfico do GBV-C frente o HIV
Apesar dos estudos serem controversos, existem fortes evidências de que o GBV-C de alguma forma inibe a replicação do HIV, onde existem várias hipóteses sobre os possíveis mecanismos pelo qual o GBV-C exerce este efeito protetor, mesmo assim estes mecanismos não estão completamente elucidados(46).
Williams, et al. 2004, estudaram 271 pacientes, que foram avaliados a partir da soroconversão por um período de 11 anos, através da análise da infecção e da presença do anticorpo anti-E2(46). Foi verificado que a infecção pelo GBV-C nos pacientes HIV leva a uma sobrevida maior nos indivíduos que apresentam maior tempo de infecção pelo GBV-C e que na medida em que ocorria o clareamento do GBV-C, os pacientes apresentavam uma piora na infecção pelo HIV(46). neste estudo os pesquisadores sugeriram que estes resultados benéficos são dependentes do tempo de infecção pelo HIV, ou seja, quanto maior o tempo de infecção pelo HIV mais o GBVC exercerá efeito protetor, fato que esclareceria os resultados opostos ao efeito protetor do GBV-C em outras pesquisas(46). Os possíveis mecanismos de efeito protetor do GBV-C frente a infecção com o HIV estão descritos abaixo.
Inibição da replicação do HIV
Uma das hipóteses que tenta explicar a forma pelo qual o GBV-C minimiza a progressão do HIV seria a ação inibitória direta do GBV-C na replicação do HIV, devido ao fato de que ambos os vírus se replicam em células mononucleares do sangue periférico inclusive em linfócitos T CD4+, T CD8+ e linfócitos B(7). Esta coinfecção poderia afetar os estágios iniciais do ciclo do HIV, como a ligação e fusão às célulasalvo, transcrição reversa, e depois a integração ao genoma da célula hospedeira, produção do pró-vírus dentre outros, prejudicando a replicação do HIV sem aumentar a toxicidade celular(7).
Indução de um perfil de citocinas favorável a infecção com HIV
Outra hipótese seria que a coinfecção GBV-C/HIV estimularia um perfil de resposta imunológica favorável frente a infecção com o HIV, induzindo a um aumento da resposta Th1, através da produção de IL-2, IL-12 e IFN gama, pelas células mononucleares estimulando a resposta imune celular(47).
Diminuição da expressão de receptores de quimiocinas
Temos também que o mecanismo protetor do GBVC na progressão do HIV teria relação com os receptores de quimiocinas CCR5 e CXCR4, que são muito importantes para que ocorra a transmissão e progressão do HIV(48). Algumas cepas de HIV utilizam o receptor CCR5 para a entrada na célula alvo, enquanto outras utilizam o co-receptor CXCR4(48). Em um trabalho publicado por Xiang, et al. 2004, um estudo in vitro foi realizado onde os pesquisadores inocularam os vírus GBV-C e HIV em células mononucleares(48). A presença do GBV-C proporcionou uma secreção de citocinas como ranTeS, MIP-1α, MIP-1β, ligantes naturais do CCR5 e o SDF1, consequentemente diminuindo a expressão de CD4, CCR5 e CXCR4 utilizados pelo HIV para a entrada celular, e ainda verificou que a coinfecção levou a uma redução de 23% na replicação do HIV(48).
Em estudo realizado por nattermann, et al. 2003, foi analisada a expressão de um dos receptores celulares utilizados pelo HIV, o CCR5, em linfócitos de pacientes HIV positivo e negativo juntamente com pacientes virêmicos e não virêmicos para GBV-C(49). Os achados demonstraram que o GBV-C levou a um aumento da secreção de citocinas e a diminuição da expressão do receptor CCR5, fato que explicaria o motivo pelo qual o GBV-C diminuiria a progressão do HIV(49).
Em um trabalho publicado por Giret, et al. 2009, foi avaliado o efeito da infecção pelo GBV-C na ativação das células T em 48 pacientes com infecção recente pelo HIV(50). Os achados confirmaram os efeitos positivos entre a carga viral do HIV-1 e as taxas de células T CD8+ e CD38(50). Foi demonstrado também que a infecção pelo GBV-C levou a uma diminuição da expressão de CD38 nas células T CD4+ e T CD8+ e de CCR5 nas células T CD8+(50). Os resultados encontrados foram independentes da carga viral do HIV-1, da contagem de células T CD4+ e de células T CD8+(50). Os autores ressaltaram ainda, que a infecção pelo GBV-C estaria associada com a menor ativação das células T, podendo ser este um mecanismo chave para proteção ao paciente infectado com HIV, diminuindo assim a progressão da doença(50).
Em contrapartida ao estudo anterior, Zaapia, et al. 2011, realizaram um estudo em um hospital na cidade de São Paulo, onde avaliaram o efeito do GBV-C na resposta imunológica ao HIV(51). Foram avaliados 159 indivíduos com infecção crônica pelo HIV, e destes 65 (40,8%) apresentaram marcadores de infecção pelo GBV-C(51). Apesar da alta prevalência encontrada, a presença do GBV-C não influenciou na replicação do HIV e na contagem de células T CD4+ e CD8+(51). A resposta imunológica pelo IFN-γ, IL-2 e CD38 não divergiu entre os grupos co-infectados GBV-C/HIV e somente HIV positivos(51). Os autores não excluíram o efeito protetor do GBVC na infecção precoce do HIV, porém não encontraram este efeito benéfico em pacientes co-infectados com HIV em fase crônica(51).
Observou-se que a proteína E2 do GBV-C se liga a CD81 das células, promovendo a liberação de ranTeS, com isso o receptor CCR5 das células mononucleares é internalizado, diminuindo sua expressão na superfície dos linfócitos, o que bloquearia a entrada do HIV na célula hospedeira(52).
Diferentes genótipos exercem efeitos diferentes
Xiang em 2006 verificou que a proteína não estrutural NS5A do GBV-C tem ação inibitória no co-receptor CXCR4, através do aumento de seu ligante SDF-1, o que diminuiria a entrada do HIV na célula hospedeira(47). Ainda mais, os autores verificaram que quando após a expressão de NS5A do GBV-C, somente os genótipos 1, 2, 3 e 5 conseguiram inibir a replicação do HIV, o que sugere que diferentes genótipos podem exercer efeitos diferentes na evolução da infecção do
HIV(47).
Perspectivas futuras sobre o GBV-C
Recentemente Martin, et al. 2011, realizaram um estudo in vitro a fim de identificar proteínas presentes no GBV-C que exerçam a função de inibir a atividade da proteína de superfície gp41 do HIV, sendo esta o peptídeo de fusão do HIV para o interior da célula alvo(53). Foram sintetizados e estudados 58 peptídeos do GBV-C correspondentes as proteínas do envelope E1(53). Destes peptídeos sintéticos, cinco apresentaram atividade redutora na fusão da gp41 a um modelo de membranas lipossomal sintetizado semelhante à membrana da célula-alvo(53). Os autores acreditam que estes peptídeos sintéticos podem contribuir para o desenvolvimento de novos agentes terapêuticos para o tratamento da AIDS(53).
Outro estudo com peptídeos sintéticos derivados do GBV-C foi realizado por Fernandez, et al. 2012(54). Os autores analisaram a atividade de um peptídeo modificado sinteticamente oriundo da região E2 do GBV-C, frente a gp41 do HIV(54). O estudo revelou que as modificações feitas no peptídeo selecionado não inibiram a fusão da gp 41 as células-alvo(54). Os estudos com peptídeos
sintéticos são recentes e apesar de serem controversos, abrem um leque para que a comunidade científica possa buscar novas alternativas para o tratamento do HIV, além de um melhor entendimento do
agente viral GBV-C(53, 54).
Dentro deste contexto, Sarah, et al. 2012(55), realizaram uma investigação in vitro da sequência genômica do GBV-C que codifica para uma serina protease (NS3), avaliando se esta protease de alguma forma afeta o ambiente celular do linfócito prejudicando a replicação do HIV. Os pesquisadores verificaram que quando a protease NS3 do genoma do GBV-C era expressa em uma linhagem humana de linfócitos T CD4+ a replicação do HIV nestes diminuía significativamente, sendo que esta redução na replicação se apresentou dependente da dose de NS3 testada. Ainda mais, a presença de NS3 do GBV-C nos linfócitos testados não inibiu a expressão dos receptores linfocitários CD4 e CXCR4 que são utilizados pelo HIV para entrada na célula hospedeira.
CONCLUSÃO
Portanto, mesmo que os mecanismos que levem à ação protetora do GBV-C sejam controversos na literatura, as evidências científicas levam a acreditar que o GBV-C traz uma melhora no prognóstico dos pacientes infectados com o HIV. O vírus da hepatite G parece estar distribuído em toda a população mundial e acredita-se que sua prevalência seja maior em indivíduos expostos a sangue e hemoderivados.
O GBV-C não apresenta grande impacto clínico nos pacientes infectados, e não causa doença hepática grave, o que leva a um desinteresse na detecção deste agente viral e de seus anticorpos em exames de rotina. Por este motivo, somado aos poucos estudos pontuais de prevalência supõe-se que este vírus seja sub-diagnosticado e sua prevalência subestimada na maioria das regiões do Brasil e do mundo.
Os estudos indicam que a coinfecção entre GBV-C e HIV é um fator de prognóstico favorável para os pacientes HIV positivo, merecendo maiores investigações na área, sejam de prevalência do GBV-C, coinfecção com o HIV e os possíveis mecanismos de interferência viral. Sabe-se que temos várias regiões em nosso país de alta prevalência de HIV, onde a variação genética do vírus é um alvo de interesse para os pesquisadores. Através destes estudos poderão se ter maiores informações sobre o GBV-C bem como sobre os seus efeitos nos pacientes HIV positivo. As pesquisas atuais do GBV-C aos quais testam in vitro a capacidade das diferentes proteínas que fazem parte do seu genoma em inibir a replicação do HIV é algo promissor para a população. Tendo em vista que a resistência aos medicamentos anti-virais é um problema enfrentado por muitos pacientes HIV positivo se faz necessário o desenvolvimento de novos fármacos antivirais para contribuir com novas estratégias de tratamento para o HIV.
REFERÊNCIAS
1. Deinhardt F, Homes AW, Capps RB, et al. Studies on the transmission of human viral hepatitis to marmoset monkeys. Transmission of disease, serial passages and description of liver lesions. Journal of experimental Medicine. 1967, 125:673-88.
2. Toyoda H, Fukuda Y, Hayakawa T, et al. Effect of GB virus C/hepatitis G virus co-infection on the course of HIV infection in hemophilia patients in Japan. Journal acquired immune Deficiency Syndromes. 1998, 17:209-13.
3. Heringlake S, Ockenga J, Tillmann HL, et al. GB virus C/hepatitis G virus infection: a favorable prognostic factor in human immunodeficiency virus-infected patients? Journal of infectious Diseases. 1998, 177:1723-6.
4. Pavesi A. Origin and evolution of GBV-C/Hepatitis G virus and reationships with ancient human migrations. Jounal of Molecular evolution. 2001, 53:104-13.
5. Abe K. GB virus C/hepatitis G virus. Japanese Journal of infectious Diseases. 2001, 54:55-63.
6. Berzsenyi MD, Bowden DS, Roberts SK. GB virus C: insights into coinfection. Journal of Clinical Virology. 2005, 33:257-66.
7. Xiang J, Wünschmann S, Diekema DJ, et al. Effect of co-infection with GB virus C (hepatitis G virus) on survival among patients with HIV infection. new england Journal of Medicine. 2001, 345:707-14.
8. Mohr EL, Stapleton JT. GB virus type C interactions with HIV: the role of envelope glycoproteins. Journal of viral hepatitis. 2009,16:757-68.
9. Nakao H, Okamoto H, Fukuda M, et al. Mutation rate of GB virus C/hepatitis G virus over the entire genome and in subgenomic regions. Virology. 1997, 233:43-50.
10. Simons JN, Desai SM, Schultz DE, et al. Translation initiation in GB viruses a and C: evidence for internal ribosome entry and implications for genomic organization. Journal of Virology. 1996, 70:6126-35.
11. Linnen J, Wages JJ, Zhang-keck ZY, et al. Molecular cloning and disease association of hepatitis C virus: a transfusion-transmissible agent. Science. 1996, 271:505-8.
12. Appel N, Schaller T, Penin F, et al. From structure to function: new insights into hepatitis C virus RNA replication. Journal Biological Chemistry. 2006, 281:9833-36.
13. Penin F, Dubuisson J, Rey FA, et al. Structural biology of hepatitis C virus. Hepatology. 2004, 39:5-19.
14. Xiang J, Klinzman D, Mclinden J, et al. Characterization of hepatitis G virus (GB-C virus) particles: evidence for a nucleocapsid and expression of sequences upstream of the E1 protein. Journal of Virology. 1998, 72:2738-44.
15. Leary TP, Muerhoff AS, Simons JN. Sequence and genomic organization of GBV-C: a novel member of the Flaviviridae associated with human non a-e hepatitis. Journal Medicine Virology. 1996, 48:60-7.
16. Franck N, Leseyec J, Guguen GC, et al. Hepatitis C virus NS2 protein is phosphorylated by the protein kinase CK2 and targeted for degradation to the proteasome. Journal of Virology. 2005, 79:2700-8.
17. Pang PS, Jankowsky E, Planet PJ, et al. The hepatitis C viral NS3 protein is a processive Dna helicase with cofactor enhanced RNA unwinding. Journal EMBO. 2002, 21:1168-76.
18. Marmor M, Hertzmark K, Thomas SM, et al. Resistance to HIV infection. Jounal of Urban Health. 2006, 83:5-17.
19. Xiang J, Daniels KJ, Soll DR, et al. Visualization and characterization of GB virus C particles: evidence for a nucleocapsid. Journal of virol hepatitis. 2002, 6:16-22.
20. Simons JN, Pilot-matias TJ, Leary TP, et al. Identification of two flavivirus-like genomes in the GB hepatitis agent. Proceedings of the National academy of Sciences. 1995, 92:3401-05.
21. Berzsenyi MD, Roberts SK. What is the role do GB virus C infection in hepatitis C virus/HIV coinfection? Journal of infectious diseases. 2006, 194:407-9.
22. Tucker TJ, Smuts HE. GBV-C/GBV-C genotypes: proposed nomenclature for genotypes 1-5. Journal of Medicine Virology. 2000, 62:82-3.
23. Mora AVM, Botelho L, Nishiya A, et al. Frequency and genotypic distribuition of GB vírus C (GBV-C) among Colombian population with hepatitis B (HBV) or hepatitis C (HCV) infection. Virology Journal. 2011, 8:345.
24. Nishiya AS, Ribeiro-dos-Santos G, Bassit L, et al. Genotype distribution of the GB virus C in citizens of São Paulo City Brazil. Instituto de Medicina Tropical de São Paulo. 2003, 45:213-6.
25. Oliveira LA, Martins RM, Carneiro MA, et al. Prevalence and genotypes of GB virus C/hepatitis G virus among blood donors in central Brazil. Memórias do Instituto Oswaldo Cruz. 2002, 97:953-7.
26. Fogeda M, Navas S, Martin J, et al. In vitro infection of human peripheral blood mononuclear cells by GB virus C/hepatitis G virus. Journal virology. 1999, 73:4052-61.
27. Alter MJ, Gallagher M, Morris TT, et al. Acute non-A-E Hepatitis in the United States and the role of Hepatitis G virus infection. New england Journal of Medicine. 1997, 336:741-6.
28. Li C, Collini P, Danso K, et al. GB virus C and HIV-1 RNA load in single virus and co-infected West African individuals. AIDS. 2006, 20:379-86.
29. Feucht HH, Zollner B, Polywka S, et al. Prevalence of hepatitis G viremia among healthy subjetcs, individuals with liver disease, and persons at risk of parenteral transmission. Journal of Clinical Microbiology. 1997, 35:767-8.
30. Ramia S, Mokhbat J, Sibai A, et al. Exposure rates to hepatitis C and G virus infections among HIV-infected patients: evidence of efficient transmission of GBV-C by the sexual route. International Journal of STD AIDS. 2004, 15:463-6.
31. Novikov DV. Molecular Biological characteristics of HCV. Abstract of dissertation for Canditate of Medical Sciences. 2000, 1-22.
32. Hamezani A, Mohraz M, Vahabpour R, et al. Frequency of hepatitis G virus infection among HIV positive subjects with parenteral and sexual exposure. Journal Gastrointestin liver disease. 2008,17:267-72.
33. Ribeiro-dos-Santos G, Nishiya AS, Nascimento CM, et al. Prevalence of GB virus C (hepatitis G virus) and risk factors for infection in São Paulo, Brasil. European Journal of Clinical. 2002, 21:438-43.
34. Halasz R, Weilanda O, Sällberg M. GBV virus C/hepatitis G virus. Scandinavian Journal of infectious Diseases. 2001, 33:572-80.
35. Gutierrez RA, Dawson GJ, Knigge MF, et al. Seroprevalence of GB virus C and persistence of RNA and antibody. Journal of Medical Virology. 1997, 53:167-73.
36. Tillmann HL, Heiken H, Knapik-botor A, et al. Infection with GB virus C and reducet mortality among HIV-co-infected patients. New England Journal of Medicine. 2001, 345:715-24.
37. Stapleton JT. GB virus type C/hepatitis G virus. Sem Liver Dis. 2003, 23:137-48.
38. Hassoba HM, Pessoa MG, Terrault NA, et al. Antienvelope antibodies are protective against GBV-C reinfection: evidence from the liver transplant model. Journal of Medical Virology. 1998, 56:253-8.
39. Ilchenko LY, Sharafanova TI, Shepeleva SD, et al. Antibodies to Hepatitis G virus in patients with chronic liver diseases. Hepatology. 2003, 5:4-6.
40. Boodram B, Hershow CR, Klinzman D, et al. GB virus C infection among young, HIV-negative injection drug user with and without hepatitis C virus infection. Journal of viral hepatitis. 2011, 18:153-9.
41. Frey SE, Himan SM, Sokol-anderson M, et al. Evidence for probable sexual transmission of the hepatitis G virus. Clinical infectious Diseases. 2002, 34:1033-8.
42. Linnen JM, Fung K, Fry KE, et al. Sequence variation and phylogenetic analysis of 5 terminus of hepatitis G virus. Journal of Virology Hepatitis. 1997, 48:2771-7.
43. Lefrére JJ, Roudot-thotaval F, Morand-joubert L, et al. Carriage of GB virus C/hepatitis G virus rna is associated with a slower immunologic, virologic and clinical progression of human immunodeficiency virus disease in co-infected persons. Journal of infectious Diseases. 1999, 179:783-9.
44. Sabin CA, Devereux H, Klinson Z, et al. Effect of co-infection with hepatitis G virus on HIV disease progression in hemophilic men. Journal acquired immune Deficiency Syndromes. 1999, 19:346-7.
45. Nunnari G, Nogro L, Palermo F, et al. Slower progression of HIV-1 infection in persons with GB virus C co-infection correlates with an intact T-helper 1 cytokine profile. Annals of internal Medicine. 2003, 139:26-30.
46. Williams CF, Klinzman D, Yamashita TE, et al. Persistent GB virus C infection an survival in HIV infected men. New england Journal of Medicine. 2004, 350:981-90.
47. Xiang J, Mclinden JH, Chang Q, et al. Characterization of a peptide domain within the GB virus C NS5A phosphoprotein that inhibits HIV replication. PLosone. 2006, 3:1-10.
48. Xiang J, George SL, Wünschmann S., et al. Inhibition of HIV-1 replication by GB virus C infection through increases in ranTeS, MIP-1α, MIP-1β, and SDF-1. Lancet. 2004, 363:2040-6.
49. Nattermann J, Nischalke HD, Kupfer B, et al. Regulation of CC chemokine receptor 5 in hepatitis G virus infection. AIDS. 2003, 17:1457-62.
50. Giret MTM, Silva TM, Sauer MM, et al. GB virus type C infection modulates T-cell activation independently of HIV-1 viral load. AIDS. 2009, 23:2277-87.
51. Zappia BLG, Barbosa JL, Brunialti CKM, et al. Influence of GB vírus C on IFN-γ and IL-2 production and CD38 expression in T lymphocytes from chronically HIV-infected-HCV-co-infected patients. Memórias do Instituto Oswaldo Cruz. 2011, 106:662-9.
52. Kaufman TM, Mclindem JH, Xiang J, et al. The GBV-C envelope glycoprotein E2 does not interact specifically with CD81, AIDS. 2007, 21:1045-8.
53. Martin SJM, Hristova K, Pujol M, et al. Analysis of HIV-1 fusion peptide inhibition by synthetic peptides from E1 protein of GB virus C. Journal of Colloid and interface Science. 2011, 360:124-31.
54. Fernandez L, Chan CW, Egido M, et al. Synthetic peptides derived from an N-terminal domain of the E2 protein of GB virus C in the study of GBV-C/HIV-1 co-infection. Journal of Peptide Science. 2012, 18:326-35.
55. George LS, Varmaz D, Tavis EJ, et al. The GB Virus C (GBV-C) NS3 Serine Protease inhibits HIV-1 replication in a CD4+ T Lymphocyte Cell Line without Decreasing HIV receptor expression. Plosone. 2012, 7:1-8.
1. Especialista (Bioquímica e Mestranda)
2. Doutora (Bióloga e Doutora)
3. Mestre (Bióloga e Doutoranda)
4. Mestre (Bioquímica e Doutoranda)
5. Doutora (Doutora e Professora adjunta da Universidade Federal do Rio Grande)
Campus Saúde
Rua: Visconde de Paranaguá 102 Centro
Rio Grande/RS CEP único: 96203-900
Telefone para contato/fax: (53)3233.8800
E-mail: e-mail: luisadias_sixcp@hotmail.com
Trabalho de revisão desenvolvido no curso de especialização em agentes infecto-parasitários de interesse humano no Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande (FURG)